肺纤维化(Pulmonary fibrosis)是由于正常的肺组织在慢性损伤中修复反应失调引起的肺部疾病,其特征是细胞外基质的过度沉积和肺实质破坏,并且导致肺顺应性降低,气体交换中断,进而出现呼吸衰竭,其中特发性肺纤维化(IPF)是最常见和普遍的肺纤维化类型【1】。特发性肺纤维化起初被认为是由慢性炎症导致,随着研究的深入,发现是由于遗传易感性、各种环境因素、肺泡上皮细胞损伤以及成纤维细胞过度增殖等多因素共同作用,从而导致的肺泡组织修复过程不良进而发展为纤维化,严重或可危及生命。目前,针对IPF的治疗手段十分有限,尚无能够显著延长病人生存时间的药物。促进纤维化后的肺组织再生有望恢复受损的肺泡组织,形成功能性的脉管结构,这为包括肺纤维化在内的呼吸疾病治疗提供新的策略。
丁楅森以往工作发现血管内皮细胞通过旁分泌“Angiocrine”因子与邻近细胞互作从而调控肺的再生和纤维化【2-8】。2024年8月28日,beat365手机官方网站丁楅森团队在Science Translational Medicine杂志(封面文章)发表题为“Inhibiting endothelial Rhoj blocks pro-fibrotic vascular intussusception and angiocrine factors to sustain lung regeneration”的研究论文,联合应用条件性基因敲除小鼠、血管铸型技术、单细胞测序、精密肺组织切片培养等多学科手段,发现在内皮细胞m6A甲基化转移酶Methyltransferase-like 3 (Mettl3)缺失时,通过调控Angiocrine因子的m6A修饰促进肺再生向肺纤维化的转变。

当期期刊封面文章(图源自Science Translational Medicine)
m6A修饰是真核生物中常见的mRNA修饰,对细胞行使功能起到了重要的作用。其参与涉及 mRNA 生命周期中诸多方面的调节,包括前体 mRNA 剪接,mRNA 出核,mRNA稳定性和翻译过程。m6A修饰是由甲基化酶(Writer)和去甲基化酶(Eraser)参与的动态可逆的调控过程,甲基化酶主要包括METTL3、METTL14和WTAP等,去甲基化酶主要包括ALKBH5和FTO等。本研究中,首先在肺再生模型中(Pneumonectomy,PNX),筛选出显著上调的m6A甲基酶METTL3,构建内皮细胞特异性敲除Mettl3(Mettl3i∆EC/i∆EC)小鼠,发现在肺再生过程中内皮细胞Mettl3缺失,会导致套叠式血管异常增多,胶原纤维沉积,小鼠肺功能下降,以及促纤维化因子上调。为了深入探索内皮细胞中METTL3调控肺再生的机制,通过联合应用MeRIP测序技术与纳米孔三代测序技术,发现METTL3通过调控 Foxo1 mRNA的m6A修饰位点进而维持套叠式血管的生成以及促再生的内皮糖酵解。
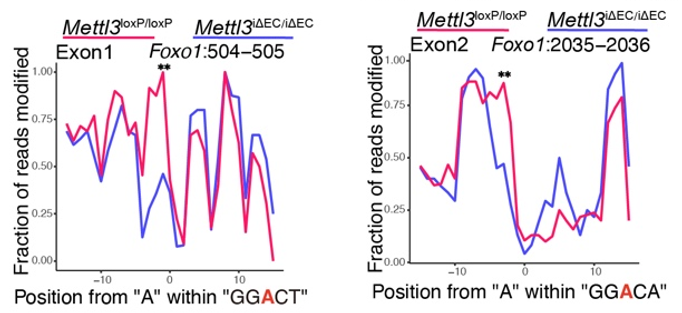
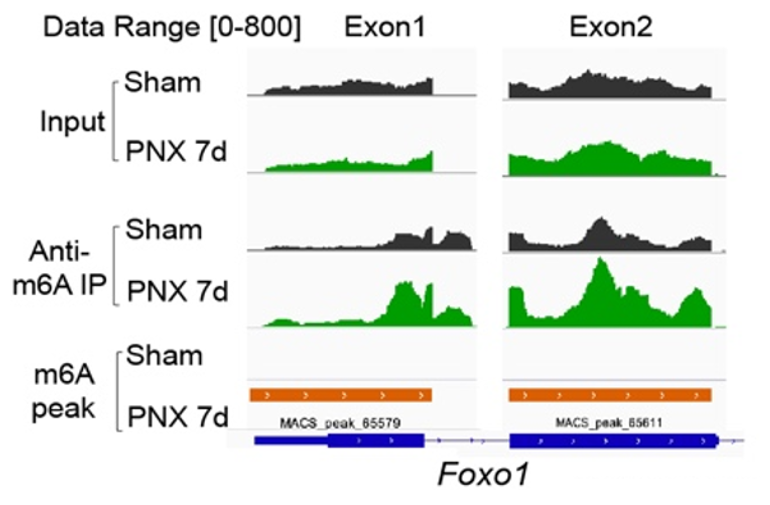
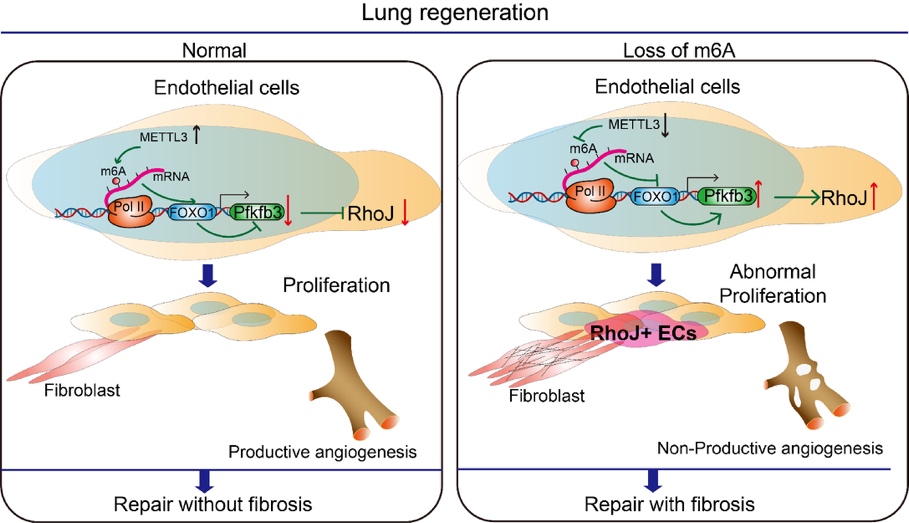
在肺再生模型中,通过对Mettl3iΔEC/iΔEC 和 Foxo1iΔEC/iΔEC小鼠进行单细胞测序,发现抑制Mettl3-Foxo1信号,刺激了高增殖高糖酵解的Pfkfb3+RhoJ+内皮细胞亚群的生成,并在博来霉素诱导的肺纤维化模型中,靶向Rhoj,发现可以缓解胶原沉积,减少套叠式血管生成,减轻纤维化。
综上,该研究发现了肺血管微环境靶点METTL3通过m6A修饰在肺再生中的调控机制,在此过程中,糖酵解增强,异常的套叠式血管生成增多,进而影响肺纤维化进展。其揭示的Angiocrine调控机制可为器官纤维化的靶向血管微环境药物提供新的靶点。
beat365博士研究生马洁、张沥引、哈尔滨医科大学张旭和beat365华西医院的张兰兰博士为论文的共同第一作者。beat365丁楅森为最后通讯作者, beat365手机官方网站为第一单位。
文章链接:https://www.science.org/doi/10.1126/scitranslmed.ado5266
参考文献
1. Rockey DC, Bell PD, Hill JA: Fibrosis--a common pathway to organ injury and failure. The New England journal of medicine 2015, 372:1138-49.
2. Rafii, S., Butler, J. M., and Ding, B. S. (2016) Angiocrine functions of organ-specific endothelial cells. Nature 529, 316-3252.
3. Cao, Z., Lis, R., Ginsberg, M., Chavez, D., Shido, K., Rabbany, S. Y., Fong, G. H., Sakmar, T. P., Rafii, S., and Ding, B. S. (2016) Targeting of the pulmonary capillary vascular niche promotes lung alveolar repair and ameliorates fibrosis. Nature medicine 22, 154-1623.
4. Rafii, S., Cao, Z., Lis, R., Siempos, II, Chavez, D., Shido, K., Rabbany, S. Y., and Ding, B. S. (2015) Platelet-derived SDF-1 primes the pulmonary capillary vascular niche to drive lung alveolar regeneration. Nature Cell Biology 17, 123-1364.
5. Ding, B. S., Cao, Z., Lis, R., Nolan, D. J., Guo, P., Simons, M., Penfold, M. E., Shido, K., Rabbany, S. Y., and Rafii, S. (2014) Divergent angiocrine signals from vascular niche balance liver regeneration and fibrosis. Nature 505, 97-1025.
6. Ding, B. S., Yang, D., Swendeman, S. L., Christoffersen, C., Nielsen, L. B., Friedman, S. L., and Cao, Z. (2020). Aging suppresses sphingosine-1-phosphate chaperone ApoM in circulation resulting in maladaptive organ repair. Developmental cell, 53(6), 677-690.
7. Chen, Y., Pu, Q., Ma, Y., Zhang, H., Ye, T., Zhao, C., Huang, X., Ren, Y., Qiao, L., Liu, H. M., Esmon, C. T., Ding, B. S., and Cao, Z. (2021) Aging Reprograms the Hematopoietic-Vascular Niche to Impede Regeneration and Promote Fibrosis. Cell Metabolism 33, 395-410 e394
8. Zhang, H., Ma, Y., Cheng, X., Wu, D., Huang, X., Chen, B., and Cao, Z. (2021). Targeting epigenetically maladapted vascular niche alleviates liver fibrosis in nonalcoholic steatohepatitis. Science translational medicine, 13(614), eabd1206.
